| Språk : |
|
| Encyclopedia gemenskap |Encyclopedia Svar |Submit fråga |Ordförråd Kunskap |Överför kunskap |
Redox polymerisation |
  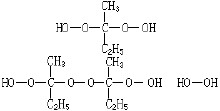         |
|
Teknik definitioner Kinesiska namn: redoxpolymeriseringsfallet Engelska namn: redoxpolymeriseringsfallet Definition: redoxinitiator av polymerisation av vinylmonomerer.Applied Science: Materials Science and Technology (ett ämne), polymera material (två personer), Polymer Science (två personer) Ovanstående innehåll av National Science and Technology Approval kommitté meddelade Kort introduktion Oxidations-reduktionsreaktionen av fria radikaler framställda genom polymerisation av vinylmonomerer. 1930 och 1940, i Tyskland, USA, Storbritannien har funnit att redoxpolymeriseringsfallet, emulsionspolymerisation lösning och därefter i syfte att förkorta induktionsperioden och tillsätta ett reduktionsmedel, resultatet inte bara förkorta induktionsperioden, men också ökade graden av polymerisation. Senare av de oxiderande och reducerande komponenterna i initiatorsystemet är ett redoxinitiatorsystem kallas. Som oxiderande och reducerande ämnen bringar elektronöverföring mellan den redoxreaktion som alstrar fria radikaler, både för att minska aktiveringsenergin för sönderdelningen av peroxid, vid en lägre temperatur (t.ex. noll till rumstemperatur), initiera polymerisationen, utan även peroxidsönderdelning kan ökas, vilket därigenom ökar polymerisationshastigheten. Därför redoxpolymeriseringsfallet och polymerisationen med låg polymerisationstemperatur snabb hastighet två fördelar. Redoxsystem klassificering klass med ett metallsalt av väteperoxid initiatorsystem bestående av sönderdelning av väteperoxid är hög aktiveringsenergi Ea, av 54 kcal / mol, inte lämpar sig ensam som initiator. Och ett metallsalt av initiatorsystem väteperoxid system, såsom H2O2-Fe2 -systemet (även känd som Fentons reagens) sönderdelning av låg aktiveringsenergi av 9,4 kcal / mol vid rumstemperatur, kan det leda till lösningspolymerisation av akrylnitril: HO-OH ─ → HO · · OH Ea = 54kcal/mol HO-OH Fe2 ─ → HO · OH- Fe3 Ea = 9.4kcal/mol Organiska material såsom väteperoxid kumenhydroperoxid CHP, isopropyl kumenhydroperoxid IPCHP, eller hur? Alkyl väteperoxid och järnsalter bestod PMHP redoxinitiering systemet kan användas som låg temperatur butadien polymerisationsinitiator. Eftersom väteperoxid till de olika, följande initiatorn polymerisationshastigheten som orsakas av motsvarande minskning: Peroxid i närvaro av ferrojoner, nedbrytningen aktiveringsenergi än väte peroxidsönderdelning aktiveringsenergi av materia ensam minskas kraftigt: Peroxid Vätgas kan också arbeta med andra metallföremål (t.ex. Cu , Co2 salt) komponent redoxinitiatorsystemet. Väteperoxid material (t.ex. tert.butylhydroperoxid) och olika metallens valens (t.ex. Cu eller Cu2 ) annorlunda sönderdelningsreaktion sker för att producera alkoxiradikaler eller alkyl peroxiradikal RO · ROO ·, RO · kan orsaka polymerisation av monomererna, och ROO · ofta inte initiera polymerisationen. ROOH Cu ─ → RO · OH- Cu2 ROOH Cu2 ─ → ROO · H Cu Ketonperoxider och Co2 salt redoxsystem bestående av den omättade polyestern kan användas för tvärbindning av reaktion vid rumstemperatur. För att koboltsalt löses i styren och omättad polyester blandning, som kan vara naftensyra eller fettsyrasalter, de kallas ofta accelerator. Keton peroxider används MEK peroxid eller cyklohexanonperoxid, metyletylketon och den tidigare är väteperoxid under sura betingelser vid syntesen är den resulterande peroxiden inte en enda struktur, så olika satser metyletylketonperoxid materialet kommer att påverka produktionen av polymert gelande och härdningstid. Metyletylketonperoxid Huvudkomponenterna är persulfat redoxinitiatorsystem som består av ett persulfat (såsom kalium-, natrium-eller ammoniumsalt) kan användas såsom en vattenlöslig polymerisationsinitiator, nedbrytningen aktiveringsenergi 33,5 kcal / mol. Persulfate sulfat och järn eller salter av bisulfit redoxsystem, deras nedbrytning aktiveringsenergi av 12,0 kcal / mol och 10 kcal / mol. Den senare har använts i vattenhaltig utfällningspolymerisation av akrylnitril. Och bisulfit reduktionsmedel liknar sulfit, tiosulfat, sulfit och dipropylenglykol ditionit, kan uttryckas med den allmänna formeln SXO konstant. Peroxid och en amin redoxinitiatorsystem bestående av en organisk kända redoxsystem. Det kan delas upp i en organisk peroxid och en amin väteperoxid systemet och organiskt material och aminsystem vari aminen är en tertiär amin, och dess roll är inte en typisk minskning, men accelerera nedbrytningen av peroxider, så Vissa människor tror att aminer är accelerator. Peroxider och aminer systemet är en typisk representant för bensoylperoxid BPO och N, N-dimetylanilin (dvs dimetylanilin DMA), kan de användas metylmetakrylat och andra monomerer kroppstemperatur aggregering. Under de senaste åren har varit DMA N, ersatte N-dimetyl-p-toluidin DMPT, delvis för att initiatorsystemet BPO-DMPT sönderdelningshastigheten och polymerisationshastigheten förhållandet snabbare initiatorsystem BPO-DMA (se tabell), andra beror på polymeren med DMPT färgstabilitet bättre än DMA. BPO-DMPT medicinsk polymer har använts i stor utsträckning i dentala material, kirurgiskt limstift material. BPO-DMPT polymerisationen mekanismen är följande: vari M betecknar monomer. Organiska peroxiden amininitiatorn Systemet används för närvarande för anaerob tändsystem, en typisk representant för kumenhydroperoxid och DMPT systemet. Det polymerisationsmekanism och BPO-DMPT är något annorlunda. Peroxid och aminväte bindning komplex bildas först, sedan uppdelat i alkoxyl radikaler initiera polymerisation: Dessutom kan du även användas ensam DMPT, DMA eller fenylhydrazin bly metakrylatmonomerer. Andra redoxinitiatorsystemet innefattar en icke-peroxid sammansättningen av redoxsystem, som inkluderar en klass av metalljonfria innehåller komponenter såsom hydroxylamin samt metalljoner Ti3 , Cr2 , V2 , MO3 -systemet, är reaktionen: NH2OH Ti3 ─ → · NH2 OH- TI4 Ceriumsalter (främst nitrat eller sulfat) med många organiska föreningar (såsom alkoholer, aldehyder, ketoner, aminer, tioler, etc.) består av ett redoxinitiatorsystem. Cerium är initiering av reaktionen med en alkoholförening bildas först, och sedan generera fria radikaler sönderdelning, kan leda till vattenlösliga monomerer: övergångsmetaller (till exempel krom, mangan, kobolt, nickel, molybden, volfram), en karbonyl-förening med en organisk halogenid (speciellt koltetraklorid) initieringssystem som enligt i 80 ~ 100 ° C leda till polymerisation av metylmetakrylat. Dess mekanism anses allmänt: övergångsmetall elektronöverföringen, dess bildande av ett högre oxidationstal, och nedbrytning av en koltetraklorid · CCL3 negativa joner och radikaler. Mn2 (CO) kan 10-CCl4 att initiera reaktionen uttryckas som: MN2 (CO) 9 CCl4 ─ → komplexa CO Complexes ─ → · CCI3 komplex Dessutom finns NaClO3-Na2SO3, KMnO4-oxalsyra, tiourea och andra KBrO3 eller KMnO4 redoxinitiatorsystem. Omräkningskursen En redox polymerisationsinitiator hastighet och omvandlingsfrekvensen för en redox-polymerisationsinitiator och initiatorn hastigheten Ri proportionell mot koncentrationen av två komponenter: Ri = kd] [reducerande] [oxiderande Formeln för sönderdelningsreaktionen hastighetskonstanten kd. Om de två redox sönderdelning av primära radikaler initiera polymerisationen är, måste multipliceras med två, om endast en friradikalinitiator behöver inte multipliceras med 2. Polymerisationshastigheten bestäms av initieringshastigheten Ri (långsammaste steget) av beslutet, och sålunda polymerisationshastigheten Rp Ri fort fort. Samtidigt öka initiatorsystemet enligt något av komponenten koncentrationen, kan öka graden av initiering, det vill säga ökar polymerisationshastigheten, men den slutliga omvandlingen av polymerisationen är inte samma sak. Allmänt, är det bäst att använda ett överskott av peroxid, Om reduktionsmedel är för hög, är det den primära radikalreaktionen, överskottet av reduktionsmedel eller polymerisation retarder från effekten, men polymerisation omräkningskursen. Fe2 utöver de primära radikala reaktioner kan förekomma följande tillägg: Den allmänna formuleringen i redox-system, oxidationsmedel av monomer från 0,1% till 1,0%, samtidigt som mängden av 0,05% till 0,1%, peroxiden och molförhållandet av reduktionsmedlet är alltid ≥ 1. Dessutom har olika komponenter påverkar också omvandlingen av ett reduktionsmedel, så att välja de komponenter för att bilda det föredragna redoxsystem. |
| Användare Omdöme |
|
Inga kommentarer |