| Språk : |
|
| Encyclopedia gemenskap |Encyclopedia Svar |Submit fråga |Ordförråd Kunskap |Överför kunskap |
Kemisk kinetik |
  |
|
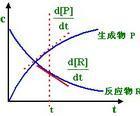
Kemisk kinetik (kemisk kinetik) är studiet av hastigheten för kemiska reaktioner och fysikaliska och kemiska reaktionen mekanism gren, som är materialegenskaperna hos objekt med tiden av icke-jämvikt dynamik systemet. Kort introduktion Kemisk kinetik, även känd som reaktionskinetik, kemisk reaktionskinetik, är en gren av fysikalisk kemi, är studiet av klassar av kemiska processer och reaktionerFysikaliska och kemiska mekanismer grenar. Det är studiet av naturen av förändringen med tiden av icke-jämvikt dynamik systemet. Dess huvudsakliga forskningsområden: molekylära reaktionsdynamik, kinetic, kemisk reaktionskinetik, makroskopiska dynamik, mikro dynamik, etc. också klassificerade enligt olika grenar av organiska kinetik kemiska reaktioner och oorganiska reaktionskinetik. Kemisk kinetik kemisk tillverkningsprocess är ofta den avgörande faktorn. Tid är en viktig variabel i kemisk kinetik. Kinetic experiment klassisk metod kan inte framställas i en enda kvanttillstånd av reaktanterna, kan inte detekteras genom en enda reaktion som genereras av en kollision mellan den framväxande produkten. Termodynamisk jämvikt egenskaper kemisk kinetik kan ges informationen, en omfattande förståelse av en kemisk reaktion process och omsättas i praktiken, inte kan göra utan kemisk kinetik. Quantum kemiska beräkningar ändå inte kan få reaktionen systemet, och fyll potentiell energi yta. Därför hade den aktuella reaktionshastigheten teori fortfarande att låna klassisk statistisk mekanik tillvägagångssätt. Sådan behandling måste finnas någon form av balans antagande, vilket gör dessa priser teorin inte kan användas för mycket snabb respons. Även tillämpningen av antagandena för balansstudier har varit många, men full teoretisk behandling av icke-jämvikt reaktionshastigheten frågan är ännu inte mogen. Molekylär balk (dvs molekylär spridning), särskilt studiet av korsade molekylär strålepitaxi metoden för tillämpning av kemiska elementära reaktionskinetik, så att i den experimentella studien på reaktionen av ett enda kollision är möjlig. Molecular beam experiment har fått en hel del klassisk kemisk kinetik inte kan få kemiska elementära reaktioner på mikroskopisk information är Molecular Reaction Dynamics en modern kemisk kinetik gräns. Termodynamisk jämvikt egenskaper kan inte ge information om kemisk kinetik. Exempelvis följande reaktion: 2H2 (gas) O2 (gas) ─ → 2H2O (gas) trots H2, är O2 och H2O i alla termodynamiska egenskaper noggrant känd, men endast antaganden genererade H2O, H2 och O2 möjlighet, inte kan förutsäga H2 och O2 under de givna förutsättningarna för vilken typ av reaktionshastigheten att generera H2O, inte kan ge H2 och O2-molekyler är molekyler som steg genom kombinationen av H2O molekyler information. Därför, en omfattande förståelse av en kemisk reaktion process och omsättas i praktiken, inte kan göra utan kemisk kinetik. [1] Studie av historien Första halvan av 20-talet, är en hel del forskning bestämning av dessa parametrar, den teoretiska analysen och användningen av parametrar för att studera akuta ingripanden. Bygger emellertid reaktionen systemet för erkännande på detektion och analys av reaktionen mellanliggande förmåga. Sen 20-talet genomförde radikala kedjereaktion kinetiska studier generellt ut, till utvecklingen av kemisk kinetik föra två trender: Först studerade de elementära reaktionskinetiken utförligt, andra är ett akut behov av en metod för att testa mellanliggande, Detta krav och elektronik, laserteknik utveckling för att främja utvecklingen av en snabb reaktion kinetik. Övergående reaktiva intermediärer upptäcks på tidsupplösning på millisekunder från 1950-talet fram till picosekunder. [1] Research Methods Kemisk kinetik forskningsmetoder är: ① fenomenologiska dynamik metoden, även kallad klassisk kemisk kinetik metod, som är från kemisk kinetik av den ursprungliga experimentella data ─ ─ koncentrationen c och tid t ─ ─ avresan, efter att ha analyserat några av de kinetiska parametrarna erhålls ─ ─ reaktionshastighetskonstant k, aktiveringsenergi Ea, pre-exponentiell faktor A. Dessa parametrar kan kännetecknas av graden av funktionerna reaktionssystemet är allmänt relation: där r är reaktionshastigheten, A, B, C, D är koncentrationen av varje ämne, α, β, γ, δ givna relativt det kända substans A , B, C, D i serien, R är gaskonstanten, T är den termodynamiska temperaturen. Kemisk reaktionsteknik kinetiska parametrar är att undersöka mekanismen av giltiga data i det aktiva mellanliggande flankdetektering tidsupplösning på millisekunder från 1950-talet till en pikosekund. ② molekylära reaktionsdynamik forskningsmetoder, från mikroskopiska molekylär nivå, är det en yuan kemisk reaktion ett visst kvanttillstånd mellan reaktantmolekyler kolliderar med varandra, atom omlagring, vilket resulterar i en viss quantum molekyler statliga produkt skilda från varandra samt enda reaktion kollision beteende. Med övergångstillståndet teori för att förklara, är det i reaktionssystemet över en potentiell partikelenergi ytsystem representerade ett kors beteende reaktion barriär. I princip, om de beräknas från quantum kemisk reaktion systemet korrekt potentiell energi yta och tillämpa mekanikens lagar beräkning representativ punkt i sin bana på, kan vi beräkna reaktionshastigheten och kemisk kinetik parametrar. Men med undantag för ett fåtal mycket enkel kemisk reaktion utanför kvantkemiska beräkningar ändå inte kan få reaktionen systemet, fullständiga och tillförlitliga potentiell energi yta. Därför hade den aktuella reaktionshastigheten teori (t.ex. bimolecular kollision teori, övergångstillstånd teori) fortfarande att låna klassisk statistisk mekanik tillvägagångssätt. Sådan behandling måste finnas någon form av balans antagande, vilket gör dessa priser teorin inte kan användas för mycket snabb respons. Även tillämpningen av jämvikt antagande har varit många, men full teoretisk behandling av icke-jämvikt reaktionshastigheten frågan är ännu inte mogen. På 1960-talet, för kemiska reaktioner på molekylär nivå av experimentella studier är det svårt att uppnå. Det är tillämpningen av modern fysikalisk kemi, avancerade analysmetoder inom atomär, molekylär-nivå forskning i olika länder och olika molekylära system primitiva enda molekyl dynamisk struktur av en kemisk reaktion, reaktionen processen och ingripanden. Det är en mikro-nivå avgång från molekylära studier av elementär reaktionshastighet och mekanism av processen, med fokus på den interna molekylär rörelse och molekylär interaktion orsakade av kollisioner att observera dynamiken i kemiska elementära processer lärande beteende. CAS Dalian Institute of Chemical Physics, State Key Laboratory of Molecular Reaction Dynamics, forskning inom detta område har enastående bidrag. ③ nätverk dynamik forskningsmetoder, innehåller det tiotals eller rentav hundratals elementära reaktionssteg viktig process kemisk reaktion (såsom kolvätepyrolys) datorsimulering och optimering för bästa design av reaktorn. [2] Använd Användningen av kemiska dynamik maj: (a) studieläkemedlet nedbrytning mekanism, (2) studera de faktorer som påverkar drogen nedbrytning och stabiliserande åtgärder, (3) förutsäga giltigheten av farmaceutiska preparat. [2] (A) reaktionshastigheten, reaktionshastigheten konstant och reaktionsordningen 1, reaktionshastigheten Gemensam reaktionshastighet per tidsenhet per volymsenhet av reaktantkoncentration minskning eller ökning av koncentrationen uttryckta produkten: -dC/dt, där C är koncentrationen av reaktanterna vid tiden t, minus koncentrationen av reaktionen minskar. [2] 2, reaktionshastigheten konstant Enligt massverkans lag, har reaktionshastigheten mellan koncentrationen av reaktanterna följande relation: -dC/dt = KC n (4-1) Där k är reaktionshastighetskonstanten är i enheter av koncentration av reaktanterna reaktionshastigheten, i enheter om [Tid] -1, storleken på reaktionstemperaturen. K-värde indikerar högre grad av reaktanter och livlig, mer instabila farmaceutiska preparat. [2] 3, reaktionsordningen Formel (4-1), är n reaktionen ordning, koncentrationen av reaktanterna Summa av allt, att reaktionshastigheten ändras med koncentrationen av reaktanter och förändra sättet. De flesta droger kan användas nollte ordningens nedbrytningsprocessen och falskt nollte ordningens reaktion, en reaktion på behandling och falska en. (A) noll-noll-ordningens reaktion och falska |
| Användare Omdöme | Allt Omdöme [ 1 ]>>> |
| ||||